Woda to tak na prawdę temat rzeka ;). Cały czas naukowcy odkrywają nowe właściwości, dotyczące tej powszechnie występującej substancji w przyrodzie. Interpretowana jest pod różnym kątem przez chemików, biologów, fizyków, przyrodników, geologów, geografów, hydrologów, lekarzy, a także i humanistów…..Skupię się bardziej na niej stricte z chemicznego punktu widzenia z wiadomych przyczyn…jestem chemikiem ;).
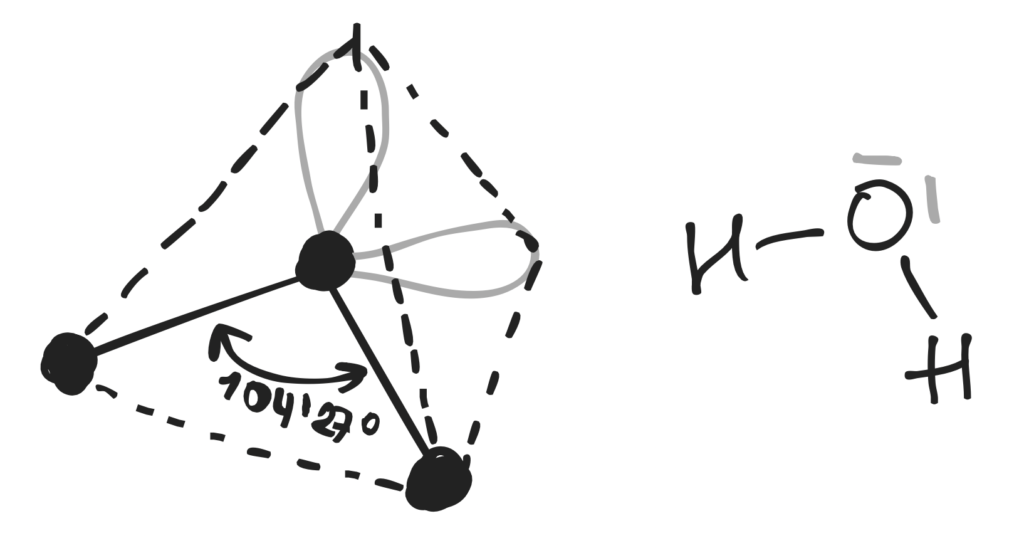
Otóż woda wydaje się być na pozór bardzo prostą substancją, bo to cząsteczka zbudowana z dwóch atomów wodoru i jednego atomu tlenu. Pomiędzy atomem tlenu i atomami wodoru występuje wiązanie kowalencyjne spolaryzowane, ale to nie wszystko :). Mianowicie wspomniana nazwa wiązania wskazuje, że cząsteczka wody jest polarna, co powoduje dość wyjątkowy (kątowy) kształt jej budowy. W zależności od stanu skupienia kąt ten może mieć wartość 104°27’, czyli inaczej też 1,82 rad (jednostka to radian) w ciekłym stanie skupienia. Natomiast w przypadku lodu (ciało stałe) kąt ten wynosi około 108°. Spowodowane jest to nierównomiernym rozmieszczeniem ładunków elektrycznych (nie mylmy z oddziaływaniem elektromagnetycznym, bo w tym przypadku odnoszę się to do ładunku elektrycznego elementarnego, związanego z cząstkami elementarnymi, czyli protony i elektrony). Wspomnę, iż na rozmieszczenie ładunku wpływa obecność dwóch par elektronów walencyjnych na atomie tlenu. Elektrony walencyjne są na ostatniej, czyli drugiej powłoce (powłoka ta określana jest symbolem „L”). Poniżej przedstawiłam przestrzenne rozmieszczenie wiązań kowalencyjnych spolaryzowanych (czarny kolor) i wolnych par elektronowych (szary kolor) w cząsteczce wody na rysunku po lewej stronie.
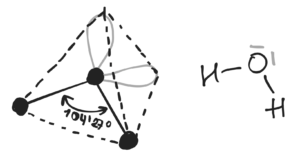
Widzimy tu kształt przypominający tetraedr, o czym mówi nam hybrydyzacja typu sp3 (czworościan foremny). Hybrydyzacja to w skrócie mieszanie się orbitali atomowych, a orbital atomowy opisuje prawdopodobieństwo występowania elektronu, co pozwala nam zobrazować przestrzenne ułożenie elektronów walencyjnych. Natomiast na rysunku po prawej stronie ukazany jest wzór elektronowo-kreskowy, na którym to rozmieszczenie atomów narysowano w sposób uproszczony. Z racji nagromadzonego ładunku ujemnego dwie wolne pary elektronowe odpychają atomy wodoru. Wobec czego powstają cząstkowe ładunki dodatnie na atomach wodoru i ujemne na atomach tlenu w wyniku wcześniej wspomnianego nierównomiernego rozkładu elektronów. Taki układ nazywamy dipolem. Każda ze wspomnianych wolnych par atomu tlenu oraz atomy wodoru mają możliwość utworzenia w sumie czterech wiązań wodorowych (rysunek poniżej).
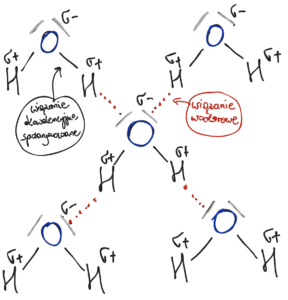
Wiązanie wodorowe to oddziaływanie elektrostatyczne między atomem o dużej elektroujemności (w tym wypadku to atom tlenu) a atomem wodoru. Trzeba zwrócić uwagę, że nie jest ono wiązaniem atomowym, gdyż nie występuje ono w obrębie jednej cząsteczki tylko między cząsteczkami. To słabe oddziaływanie toteż przedstawia się je rysując kropki lub przerywane linie.
Jest jeszcze więcej szczegółów do opisania, na przykład na temat wpływu wiązania wodorowego, właściwości czy zastosowania wody, ale to już zapraszam do następnych części mojego bloga ;).